Die Kunst der Proteinkristallisation
Viele chemische Reaktionen in Zellen werden durch Enzyme katalysiert und die dreidimensionale Struktur der Enzyme ist der Schlüssel zu ihrer Funktion. Da Struktur und Funktion miteinander verknüpft sind, werden Proteinstrukturen ein immer wichtigerer Bereich in Biologie, Biochemie und Medizin.
Warum sind Proteinstrukturen wichtig für CEPLAS?
Der Klimawandel und die immer kleiner werdende Fläche für Ackerbau machen es immer schwieriger, die wachsende Weltbevölkerung zu ernähren. Daher benötigen wir in Zukunft Nutzpflanzen, die Nährstoffe und Licht effizienter nutzen und mit Trockenheit besser zurechtkommen. Pflanzen, die C4 Photosynthese betreiben, können das bereits. Wären wir imstande, unsere Nutzpflanzen in die Lage zu versetzen, C4 Photosynthese zu betreiben, wäre das ein großer Schritt zu diesem Ziel. Doch bevor wir daran denken können, müssen wir zunächst die molekularen Unterschiede zwischen einer C3 und einer C4 Pflanze verstehen und dafür mehr über die daran beteiligten Enzyme und ihre Struktur lernen.
In meinem Projekt möchte ich die Struktur einer Proteinkinase bestimmen, die an der Regulation der C4 Photosynthese beteiligt ist.
Allerdings ist das Bestimmen einer Proteinstruktur keine leichte Aufgabe
Um die Struktur der regulatorischen Proteinkinase zu bestimmen, wende ich die Methode der Röntgenstrukturanalyse an. Dafür muss ich das Protein zunächst reinigen und kristallisieren. Danach wird der Proteinkristall einem Röntgenstrahl ausgesetzt. Die Röntgenstrahlen werden am Proteinkristall gebeugt und aus dem entstehenden Beugungsbild lässt sich die dreidimensionale Struktur des Proteins berechnen.
Doch dazu wird erst mal ein Proteinkristall benötigt und Proteinkristalle zu bekommen kann harte Arbeit sein. Da jedes Protein unterschiedlich ist gibt es kein allgemein gültiges Protokoll für die Kristallisation. Stattdessen müssen die Kristallisationsbedingungen für jedes Protein experimentell herausgefunden werden. Verschiedene Bedingungen müssen mit Hochdurchsatzmethoden untersucht werden, da es eine Vielzahl von Parametern gibt, welche die Kristallisation beeinflussen. Puffer, pH-Wert, Salze, Ausfällungsmittel, Temperatur, Proteinkonzentration und Inkubationszeit seien hier exemplarisch genannt. Wird auf diesem Weg ein Proteinkristall erhalten, müssen seine Beugungseigenschaften mit einem Röntgenstrahl untersucht werden. Je besser die Beugung, desto besser kann später die Proteinstruktur berechnet werden.
Zu Beginn muss ich zunächst die Proteinkinase reinigen und auf ca. 10 mg/mL aufkonzentrieren. Klingt einfach – ist es aber nicht, da das Protein zum Ausfällen neigt. Danach wird es in den Kristallisationsansätzen eingesetzt. Kommerziell verfügbare Screening-Kits, Roboter und automatische Fotosysteme der „X-ray Facility and Crystal Farm“ an der Heinrich-Heine Universität erleichtern es mir, die zuvor genannten Bedingungen in einer überschaubaren Zeit zu untersuchen. Bislang haben sich aber alle erhaltenen Kristalle als Salzkristalle herausgestellt.
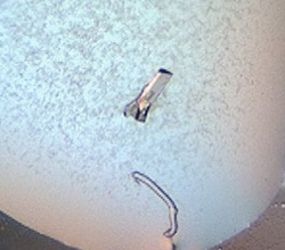
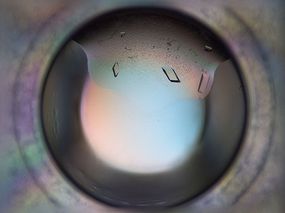
Abbildung 1: Zwei verschiedene Salzkristalle aus meinen Screens.
Aber wie kann ich schnell zwischen Protein- und Salzkristallen unterscheiden?
Dazu nutze ich aus, dass (fast) alle Proteine die Aminosäure Tryptophan enthalten – und diese unter UV-Licht fluoresziert, wohingegen Salzkristalle nicht fluoreszieren. Als Beispiel seien hier Proteinkristalle der L-Ectoin Synthase unter normalem Licht und unter UV-Licht gezeigt.
Nach einem Jahr kann ich sagen, dass die Kristallisation von Proteinen eine Herausforderung ist. Aber es gibt auch eine große Motivation für mich: Mit den Kristallen und der später berechneten Struktur einen Beitrag dazu zu leisten, die C4 Photosynthese besser zu verstehen. Ein kleiner Schritt auf dem Weg zu einem großen Ziel: Eine wachsende Weltbevölkerung zu ernähren.
Beitrag von Johannes Schwabroh, Institut für Biochemische Pflanzenphysiologie, HHU