Die vereinende Kraft des Stresses: Zusammenschluss von mRNAs und Proteinen
Steigende Temperaturen sowie die zunehmende Versalzung von Ackerflächen führen jährlich zu substanziellen Einbußen landwirtschaftlicher Erträge. Im Zuge des Klimawandels nehmen diese Effekte zu und erhöhen den Druck auf Nutzpflanzenzüchter und Landwirte gleichermaßen bei schlechteren Bedingungen gleiche oder sogar höhere Erträge zu erzielen. Um effektivere und gegen diese Umweltbedingungen resistentere Linien zu züchten und ertragsbringend anzubauen, ist es essenziell die molekularen Mechanismen zu verstehen, die eine Temperatur- und Saltzresistenz in Pflanzen vermitteln können.
Wie reagiert eine Pflanze auf Hitze oder Salzstress auf molekularer Ebene?
Einsetzendem Hitze- oder Salzstress begegnet die Pflanzenzelle mit einer sofortigen, globalen Umstellung des mRNA und Proteinstoffwechsels. Die Regulation des mRNA-Pools erfolgt u.a. über die Bildung von mikroskopisch sichtbaren mRNA-Protein-Aggregaten (mRNPs), die auch Stress-Körperchen genannt werden. Durch die Rekrutierung an diese Strukturen werden die mRNAs der Translationsmaschinerie entzogen, wodurch gewährleistet wird, dass nur Proteinen produziert werden, die unentbehrlich für das Überleben der Pflanzenzelle sind. Gleichzeitig werden die Sortierung und der Abbau von Proteinen über endosomale Strukturen reguliert. Dieser Prozess wird durch hochkonservierte Proteinkomplexe (ESCRT genannt) reguliert und gewährleistet den Stress-spezifischen Abbau von Proteinen in der Pflanzenzelle.
Synchronisierung von Proteinproduktion und Proteinabbau
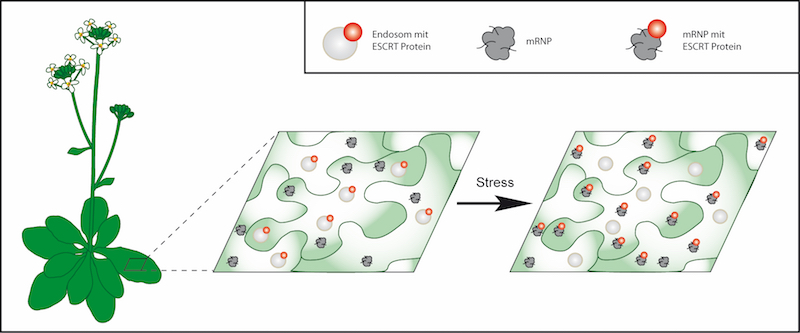
Neue Forschungsergebnisse aus unserer Arbeitsgruppe zeigen, dass ein Schlüsselprotein des ESCRT-abhängigen Proteinabbaus mit mRNP-spezifischen Proteinen interagiert. Zudem ist eine stressabhängige Rekrutierung des ESCRT Proteins an neu gebildeten Stress-körperchen zu beobachten (Abbildung 1). Dies legt einen Zusammenhang zwischen den beiden zellulären Prozessen nahe. Eine räumliche und funktionale Kopplung von mRNPs und ESCRT wäre ein eleganter Mechanismus um Proteinproduktion und Proteinabbau zu koordinieren.
Folgende Fragen versuchen wir durch molekulare, zellbiologische und biochemische Methoden zu klären: Wird das ESCRT-Protein durch die räumliche Umlagerung an mRNPs inaktiviert und damit der ESCRT-abhängige Proteinabbau unterdrückt? Nimmt das ESCRT-Protein eine bisher unbekannte Funktion in mRNPs ein? Oder werden durch die Proteininteraktion die beiden Kompartimente als ganzes räumlich assoziiert? Durch die Klärung dieser Fragen wäre es möglich mehr über die generelle Regulation von Stress-relevanten mRNAs und Proteinen zu erfahren und die Anpassung von Nutzpflanzen an zukünftige, widrige Lebensbedingungen voranzutreiben.
Beitrag von Heike Wolff, AG Hülskamp, Botanisches Institut, Universität Köln